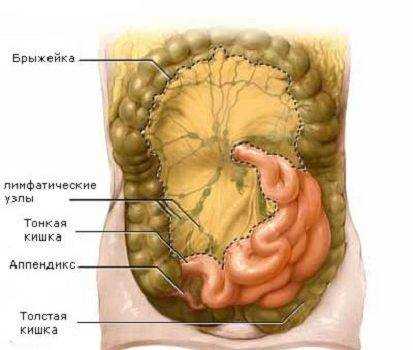
Технические осложнения. Так же, как почти все инвазивные методы лечения, ТПП и, в меньшей степени, энтеральное питание имеют свой круг осложнений (табл. 2-9 и 2-13), которые могут быть успешно предупреждены, если осуществляется тщательный контроль за проведением ПП. Частота технических осложнений при постановке центральных венозных катетеров у детей существенно снизилась благодаря четкому соблюдению всех правил осуществления этих манипуляций и рентгенологическому контролю положения катетера.
Таблица 2-13. Возможные метаболические осложнении полного парентерального питания 
Сердечной аритмии, связанной с раздражением катетером, можно избежать, если кончик катетера устанавливать в месте впадения верхней полой вены в правое предсердие, а не в полость сердца. Рентгенологический контроль положения катетера позволяет исключить такое осложнение, как некроз печени в результате инфузии гипертонических растворов непосредственно в печеночные вены.
С заменой поливиниловых катетеров на силиконовые снизилась частота реакций на катетер, как на инородное тело, реже возникают перфорация вены и тромбоз подключичной или верхней полой вены. Подшивание катетера к коже в месте его входа и контроль положения прн каждой перевязке, производимой через день, значительно уменьшают возможность случайного смещения катетера. Однако даже при правильном его положении может возникнуть тромбоз вены, особенно у тяжелых больных с сепсисом и замедленной циркуляцией. Тромбоз верхней полой вены в редких случаях может принести к синдрому верхней полой вены, не представляющему серьезной проблемы.
Хотя при патологоанатомическом исследовании детей, у которых стоял катетер в верхней полой вене, иногда обнаруживается тромбоэмболия, клинические ее проявления возникают чрезвычайно редко. Легочная эмболия также описана как редкое осложнение у грудных и маленьких пациентов с длительным стоянием центрального венозного катетера. При парентеральном питании через периферические вены удается избежать большинства технических осложнений, присущих центральным венозным катетерам.
Наиболее частые нежелательные последствии катетеризации периферических вен — флебиты и поверхностные инфильтраты, которые можно предупредить путем одновременной инфузии жировых эмульсий. Кроме уменьшения осмолярности и увеличения рН инфузата, добавление жиров обеспечивает непосредственную механическую защиту вены от флебита.
Септические осложнения. Сепсис — одно из наиболее частых и серьезных осложнений парентерального питания у детей через центральные вены. Достоверно установлено, что при длительном нахождении в центральной вене катетер может быть источником бактериемии и септицемии. Микроорганизмы попадают в кровоток непосредственно с катетера, из инфицированных растворов либо из удаленных септических очагов.
Однако в последнем случае катетер, являясь инородным телом, фокусирует на себе бактериальный рост. Наиболее важные факторы, способствующие уменьшению частоты септических осложнений, — постановка катетера в строго асептических условиях и тщательный уход за ним со сменой повязок через день. Кроме того, свести до минимума риск инфицирования позволяет использование катетера только для парентерального питания, исключая заборы крови через этот катетер, переливание препаратов крови или введение лекарственных веществ.
Создание специальной инфузионной бригады в нашем госпитале и строгое соблюдение всех правил парентерального питания привели к уменьшению частоты сепсиса с 16% до 3,2% в течение первых же 2,5 лет работы бригады. За последние 10 лет существования этого коллектива частота сепсиса при ТПП через центральные вены составляет в среднем 4,5%.
Катетеризационный сепсис у больных, получающих парентеральное питание, проявляется лихорадкой, лейкоцитозом, «необъяснимой» глюкозурией или любой комбинацией этих симптомов. Инфекция подтверждается высевом микроорганизмов из крови, взятой из катетера или из любой другой вены. При отсутствии интоксикации катетер должен быть оставлен в вене на первые 24—48 часов после выявления бактериемии, поскольку около 50% лихорадящих больных, у которых стоит катетер в центральной вене, имеют иные причины лихорадки.
Если не обнаружены никакие другие очаги сепсиса, катетер следует удалить. Возможен и альтернативный подход — сразу после получения положительных результатов посева крови начать внутривенное введение через этот катетер антибиотиков. Во многих случаях центральный венозный катетер может быть «спасен» с помощью 5—10-дневного курса внутривенного (через этот катетер) введения антибиотиков.
Поскольку именно лихорадящие пациенты чаще всего нуждаются в парентеральном питании, важно очень четко контролировать и документировать у них все, что связано с использованием катетера. Парентеральное питание никогда не является экстренным мероприятием, а потому при наличии показаний к ПП у лихорадящего больного он должен быть тщательно обследован для выяснения причин лихорадки перед тем. как приступить к ПП в центральные пены.
Парентеральное питание ни в коем случае не следует начинать на ранних стадиях тяжелой инфекции, особенно при рецидивирующей септицемии. Если же ПП проводится на фоне лихорадки, необходимы регулярные посевы крови до тех пор, пока больной не перестанет лихорадить (каждые 1—3 дня).
Парентеральное питание через периферические вены позволяет избежать многих септических и технических осложнений, свойственных центральным венозным катетерам. Мы не наблюдали у детей ни одного случая катетеризационного сепсиса, связанного с парентеральным питанием через периферические вены как с использованием жиров, так и без них.
Метаболические осложнения. Все известные метаболические нарушения могут возникнуть при ТПП, наиболее частые из них представлены в таблице 2-13. Если эти осложнения остаются долгое время нераспознанными, развиваются серьезные последствия. Однако тщательный контроль парентерального питания с соответствующей коррекцией позволяет большинству пациентов достаточно легко приспосабливаться к ТПП.
Гипергликемия. В начальных стадиях парентерального питания может отмечаться повышенный уровень глюкозы крови, что лечения не требует, если не приводит к глюкозурии 4+ или значительному осмотическому диурезу. При повышении скорости ннфузии или концентрации глюкозы в течение 48-72 часов парентерального питания включаются эндогенные механизмы секреции инсулина и уровень глюкозы крови возвращается к норме. Если гипергликемия не проходит за этот период, то к инфузату следует добавить инсулин.
Дети, не страдающие диабетом, редко нуждаются во введении инсулина. Пациенты, у которых на фоне стабилизации состояния при парентеральном питании внезапно увеличивается уровень глюкозы крови более 10 ммоль/л или которые но иным причинам требуют дополнительных повышенных доз инсулина, должны быть тщательно обследованы с целыо выявления возможных других причин гипергликемии, в частности — сепсиса.
Гипогликемия. Хотя такие симптомы гипогликемии, как обильное потоотделение, спутанное сознание или возбуждение, описаны при внезапном прекращении парентерального питания, мы редко наблюдаем это осложнение у детей. Тем не менее, в любом случае, когда ТПП по тем или иным причинам внезапно прерывается, необходимо вводить 10% декстрозу. При прекращении парентерального питания «уходить» от него следует постепенно.
Пациенты, подвергающиеся большим хирургическим вмешательствам, часто становятся менее толерантными к глюкозе в связи с секрецией эндогенных гормонов или инсулиновой резистентностью. Поэтому мы рекомендуем при проведении ПП сокращать вдвое скорость инфузии или вовсе ее прекращать, когда больной берется в операционную. Скорость инфузии может быть восстановлена до предоперационных показателей через 48 часов после операции при условии, что концентрация глюкозы в крови возвратилась к обычному уровню.
Гиперкалиемия. У пациентов, получаюших парентеральное питание, может отмечаться повышение уровня калия сыворотки, если в силу анаболической недостаточности вводимый калий не утилизируется полностью. Гиперкалиемия может развиваться также в результате снижения функции почек или сердечного выброса с метаболическим ацидозом при тканевом некрозе или системном сепсисе. В таких ситуациях количество калия в инфузате должно быть уменьшено либо его вовсе следует исключить, пока гиперкалиемия не будет ликвидирована.
Гипокалиемия. Для ассимиляции вводимых при парентеральном питании растворов и синтезе белка в организме требуется повышенное количество внутриклеточного калия. Поэтому калий необходимо вводить внутривенно из расчета 2— 4 ммоль/кг/сут для грудных и маленьких пациентов или 40 ммоль/л для более старших детей и подростков. Могут потребоваться и более высокие дозы, показания к применению которых возникают на основе результатов регулярного исследования концентрации калия в сыворотке.
Гипокальциемия/гиперкальцемия, гипофосфатемия/гиперфосфатемия. Эти состояния, описанные у пациентов, получающих ТПП, обычно возникают, когда к растворам для ТПП добавляются неадекватные количества кальция и фосфора. Котонных редких осложнении можно избежать, тщательно контролируя уровень кальция и фосфора в сыворотке. В связи с продолжающимся ростом дети, но срагзнению с подростками и взрослыми, нуждаются в относительно больших количествах кальция и фосфора.
Гипомигнезиемия. Подобно калию и фосфору, магний требуется при ускоренных процессах анаболизма и синтеза белка. Гипомагнезиемия может проявляться галлюцинациями, головокружениями, кишечной непроходимостью и гиперрефлексией. Добавление соответствующего количества магния к инфузату полностью устраняет это осложнение.
Недостаточность микроэлементов. Недостаточность цинка нередко возникает при длительном парентеральном питании, обычно у детей с диареей. Клинические проявления заключаются в выпадении волос, себореином дерматите с локализацией вокруг носа и рта и иногда в кишечной непроходимости. Дефицит меди приводит к гино- или нормохромной анемии, нейтропении, депигментации кожи и волос, гипотонии, задержке психомоторного развития и остеопорозу. Недостаточность хрома встречается чрезвычайно редко и может вызывать диабетоподобный синдром.
Дефицит селена — возможное осложнение очеиь длительного парентерального питания — проявляется мышечными болями и кардиомиопатией. Недостаточность этих микроэлементов редко возникает у больных, получающих добавки микроэлементов к инфузату.
Недостаточность жирных кислот/гиперлипидемия. Лабораторные признаки выраженной недостаточности эссенциальных жирных кислот обычно развиваются не раньше, чем через 2 3 недели безжирового парентерального питания, и заключаются в повышении в сыворотке содержания 5, 8, 11-триеновой кислоты, низком уровне линолевой и арахилононой кислот и увеличении выше 0,4 соотношения триеновой-тетраеновой кислот.
Клинические симптомы, как правило, появляются не раньше, чем через 2—3 месяца лечения без жировых эмульсий, и включают в себя чешуйчатый эритематоз, папулезную кожную сыпь, преимущественно в области конечностей, грудной клетки и лица. В предыдущем разделе уже было указано, что с этой сыпью можно справиться введением как минимум 4% суточных калорических потребностей в виде линолевой кислоты. Благодаря тому, что прн парентеральном питании часть суточных калорийных потребностей обычно вводится внутривенно в виде жиров, недостаточность жирных кислот развивается редко.
Большинство больных, получающих жировые эмульсии, имеют нормальный уровень триглицерида и холестерина в сыворотке. В некоторых редких случаях у пациентов, получающих парентеральное питание дольше месяца, содержание триглицерида в сыворотке может колебаться в пределах 3,5— 4,0 ммоль/л (в норме 0,6—1,7 ммоль/л), а показатели холестерина — 4,0—6,5 ммоль/л (в норме 2,5—4,0 ммоль/л). Эти изменения редко вызывают какие-либо последствия, и показатели возвращаются к норме обычно сразу после прекращения инфузии жиров.
Нарушения функции печени. Хотя имеются сообщения о нарушениях функции печени, возникающих со 2-го до 14-го дня после начала ТПП, таких как повышение в сыворотке уровня глютаматоксалоацетатной трансаминазы (SGOT) и лакта татдегидрогеназы (ЛДГ), глютаматпируватной трансаминазы (SGPT) и билирубина, однако гистологическое исследование печеночной ткани не выявляет каких-либо патологических изменений.
Указанные отклонения обычно преходящи, и в большинстве случаев показатели возвращаются к норме сразу после прекращения парентерального питания. Возникающие изменения, как правило, не зависит от того, получает пациент внутривенно жировые добавки к инфузату или нет. Гистологически у большинства больных, получающих жиры внутривенно дольше 1 месяца, в печени в клетках Купфера обычно обнаруживаются жировые пигменты. Роль подобного депонирования пигментов пока еще недостаточно ясна.
Холестатическая желтуха, связанная с ТПП, более часто встречается у недоношенных детей, чем у старших пациентов, что, по-видимому, связано с незрелостью билиарной экскреторной системы. Хотя холестатическая желтуха обычно исчезает через 2—3 недели после прекращения парентерального питания, однако в некоторых осложненных случаях может развиться печеночная недостаточность, иногда даже с летальным исходом. Патофизиология подобного тяжелого поражения печени не ясна, однако не исключено, что определенную роль здесь играет полное отсутствие энтерального питания, а соответственно и отсутствие энтеральной стимуляции выделении желчи, приводящее к ее застою.
Аллергические реакции. Дли детей, получающих регулярно интралипид, довольно характерно развитие в периферической крови эозинофилии в пределах 5—10%. В редких случаях этот показатель может достигать 35%. Подобные изменения не имеют особого клинического значения, если не сопровождаются кожной сыпью или другими проявлениями аллергии, и обычно исчезают, как только прекращается введение интралипида.
Гипергидратация и дыхательная недостаточность. Гипергидратация, сопровождающаяся отеком легких, периферическими отеками или сердечной недостаточностью, редко возникает в тех случаях, когда соблюдаются все правила, описанные выше, а парентеральное питание осуществляется по строгим показаниям и с тщательным контролем.
Проведенные в нашей клинике исследования с применением нерадиоактивных изотопов окиси дейтерия показали, что общее содержание воды в организме во время парентерального питания не повышается, а даже уменьшается параллельно с ростом МТ. Эти данные подтверждают гипотезу о том, что весовые прибавки при парентеральном питании связаны в большей степени с увеличением тканевой массы, чем с задержкой воды.
У пациентов с нарушениями функции легких значительная нагрузка декстрозой при парентеральном питании может способствовать развитию дыхательной недостаточности. Подобное осложнение объясняется повышенной продукцией углекислоты, связанной с углеводным обменом (1 моль СО, продуцируется на каждый моль поглощенного кислорода: RQ—1), что требует увеличения дыхательной активности.
Если такие больные уже находятся на ИВЛ. то переход на самостоятельное дыхание бывает затруднен. Лечение заключается в уменьшении нагрузки декстрозой и в замещении декстрозных калорий жировыми (RQ=0,7). Данное осложнение подчеркивает необходимость точного расчета соотношения калорий, обеспечиваемых глюкозой, белками и жирами. Подобные расчеты достаточно хорошо разработаны для взрослых и продолжают разрабатываться в настоящее время для грудных и маленьких детей.
К.У. Ашкрафт, Т.М. Холдер
Парентеральное питание (ПП) – это введение необходимых для нормальной жизнедеятельности организма питательных веществ непосредственно в сосудистое русло (или другие внутренние среды). Это означает, что вводимые в виде стерильных питательных растворов нутриенты поступают прямо в кровь и минуют желудочно-кишечный тракт.
В этой статье мы ознакомим вас с показаниями и противопоказаниями, видами, вариантами и правилами введения, возможными осложнениями и препаратами парентерального питания. Эта информация поможет составить представление о таком методе доставки питательных веществ, и вы сможете задать возникающие вопросы врачу.
Цели назначения ПП направлены на восстановление и поддержание кислотно-щелочного и водно-электролитного баланса и обеспечение организма всеми необходимыми энергетическими и строительными компонентами, витаминами, микро- и макроэлементами. Существует 3 основные концепции такого питания. Согласно «Европейской концепции», созданной в 1957 году доктором A. Wretlind, и «Американской концепции», разработанной в 1966 году S. Dudrick, различные препараты для ПП вводятся по разным принципам раздельно. А по концепции «все в одном», созданной в 1974 году, все необходимые жировые эмульсии, электролиты, аминокислоты, витамины и моносахариды перед инъекцией смешиваются. Сейчас в большинстве стран мира специалисты отдают предпочтение именно такому введению средств для ПП, а при невозможности смешивания каких-либо растворов их внутривенное вливание выполняется параллельно с применением V-образного проводника.
Содержание
- 1 Виды
- 2 Показания
- 3 Противопоказания
- 4 Как вводятся препараты
- 5 Основные виды препаратов
- 6 Принципы парентерального питания
- 7 Растворы аминокислот
- 8 Донаторы энергии
- 9 Витамины и микроэлементы
- 10 Двух- и трехкомпонентные растворы
- 11 Мониторинг состояния пациента при парентеральном питании
- 12 Возможные осложнения
- 13 К какому врачу обратиться
- 14 Посмотрите популярные статьи
- 15 Технические осложнения парентерального питания
- 16 Септические осложнения парентерального питания
- 17 Метаболические осложнения парентерального питания
- 18 Нарушения функции печени
- 19 Аллергические осложнения парентерального питания
Виды
 Выделяют 3 вида парентерального питания: тотальное, смешанное и дополнительное.
Выделяют 3 вида парентерального питания: тотальное, смешанное и дополнительное.
ПП может быть:
- полное (или тотальное) – все необходимые вещества поступают только в виде инфузионных растворов;
- дополнительное – такой способ дополняет зондовое или пероральное питание;
- смешанное – одновременное сочетание энтерального и парентерального питания.
Показания
ПП может назначаться в следующих случаях:
- невозможность введения питательных веществ пероральным или энтеральным путем на протяжении недели у стабильных пациентов или в более короткие сроки у больных с истощением (как правило, с нарушениями функционирования органов пищеварения);
- необходимость временного прекращения переваривания пищи в кишечнике (например, создание «режима отдыха» при язвенном поражении кишечника);
- значительные потери протеина и интенсивный гиперметаболизм, когда энтеральное питание не может восполнить недостаточность питательных веществ.
Противопоказания
ПП не может проводиться в следующих клинических случаях:
- существует возможность введения питательных компонентов другими путями;
- аллергические реакции на применяемые препараты для ПП;
- невозможность улучшения прогноза заболевания путем проведения ПП;
- период электролитных нарушений, шоковых реакций или гиповолемии;
- категорический отказ пациента или его опекунов.
В некоторых вышеописанных случаях применение элементов ПП является допустимым для проведения интенсивной терапии.
Как вводятся препараты
Для проведения ПП могут использоваться следующие пути введения (или доступы):
- путем инфузии в периферическую вену (через катетер или канюлю) – обычно проводится при необходимости такого способа питания в течение 1 суток или при дополнительном введении препарата на фоне основного ПП;
- через центральную вену (через временный или постоянный центральный катетер) – выполняется при необходимости обеспечения более длительного ПП;
- альтернативные сосудистые или внесосудистые доступы (перитонеальная полость) – применяются в более редких случаях.
При центральном доступе ПП обычно проводится через подключичную вену. В более редких случаях препараты вводят в бедренную или яремную вену.
Для проведения ПП могут применяться следующие режимы введения:
- циклическое введение на протяжении 8-12 часов;
- продленное введение на протяжении 18-20 часов;
- круглосуточное введение.
Основные виды препаратов
Все средства для ПП принято разделять на две основные группы:
- донаторы пластического материала – аминокислотные растворы;
- донаторы энергии – жировые эмульсии и растворы углеводов.
Осмолярность препаратов
Осмолярность вводимых при ПП растворов – основной фактор, который должен учитываться при таком способе питания. Он обязательно должен приниматься во внимание во избежание развития гиперосмолярной дегидратации. Кроме этого, при применении высокоосмолярных растворов всегда должен учитываться риск возникновения флебитов.
Осмолярность плазмы человека – 285-295 мосм/л. Это означает, что в периферическую кровь могут вводиться только растворы, осмолярность которых близка к таким физиологическим показателям. Именно поэтому при проведении ПП отдается предпочтение центральным венам, так как подавляющее количество применяемых препаратов имеет более высокие показатели осмолярности, а введение в периферическую вену веществ, осмолярность которых превышает 900 мосм/л, категорически противопоказано.
Границы максимальных инфузий
 Допустимая скорость введения разных растворов для парентерального питания различна и зависит от их состава.
Допустимая скорость введения разных растворов для парентерального питания различна и зависит от их состава.
При проведении ПП темп поступления растворов зависит от состояния больного и регулируется его организмом. При назначении таких препаратов врач решает поставленную перед ним задачу и строго соблюдает максимальные суточные дозировки и скорость введения средств для ПП.
Максимальная скорость поступления растворов для ПП в вену такова:
- углеводные – до 0,5 г/кг/ч;
- аминокислотные – до 0,1 г/кг/ч;
- жировые эмульсии – 0,15 г/кг/ч.
Желательно вливание таких препаратов проводить длительно или применять автоматические приспособления – инфузоматы и линиематы.
Принципы парентерального питания
Для адекватного проведения ПП должны соблюдаться следующие правила:
- Растворы препаратов должны поступать в организм в виде компонентов, необходимых для метаболических потребностей клеток (т. е. в виде таких нутриентов, которые уже прошли энтеральный барьер). Для этого применяются белки, углеводы и жиры в виде аминокислот, моносахаридов и жировых эмульсий.
- Инфузии высокоосмолярных препаратов выполняются исключительно в центральные вены.
- При проведении вливания строго соблюдается скорость введения инфузионных растворов.
- Энергетические и пластические компоненты вводятся одновременно (применяются все незаменимые нутриенты).
- Системы для внутривенных инфузий обязательно заменяются на новые через каждые 24 часа.
- Потребность в жидкости рассчитывается для стабильного пациента в дозе 30 мл/кг или 1 мл/ккал. При патологических состояниях доза увеличивается.
Растворы аминокислот
В организме практически нет запасов протеина, и в условиях интенсивного метаболического стресса у человека быстро развивается белково-энергетическая недостаточность. Ранее для восполнения утраченных протеинов применялись белковые гидролизаты, кровь, плазма и альбумин, но они обладали низкой биологической протеиновой ценностью. Теперь для восполнения недостатка белков при ПП используются растворы L-аминокислот.
Потребность организма в таких веществах определяется выраженностью метаболического стресса, и дозировка препаратов для ПП колеблется в пределах 0,8-1,5 г/кг, а в некоторых случаях достигает до 2 г/кг. Введение более высоких доз большинством специалистов считается нецелесообразным, так как такое дозирование будет сопровождаться адекватной утилизацией протеинов. Скорость введения этих препаратов должна составлять 0,1 г/кг в час.
Объем вводимых аминокислотных растворов всегда определяется необходимостью достижения положительного азотистого баланса. Такие субстраты применяются исключительно как пластический материал, и поэтому при их введении обязательно проводится инфузия растворов-донаторов энергии. На 1 г азота добавляется 120-150 небелковых (жировых и углеводных) килокалорий энергоносителей.
Фармакологические компании выпускают аминокислотные составы препаратов для ПП, руководствуясь различными принципами. Ряд растворов создается на основе имеющего наибольшую биологическую ценность аминокислотного состава «картофель-яйцо», а другие препараты содержат все незаменимые аминокислоты.
Дополнительно в состав растворов аминокислот могут вводиться:
- электролиты;
- витамины;
- янтарная кислота;
- энергоносители – ксилит, сорбит.
Абсолютных противопоказаний для применения таких белковых препаратов нет. Относительно противопоказано их использование в следующих случаях:
- приводящий к нарушению утилизации аминокислот ацидоз;
- сердечная недостаточность, нуждающаяся в ограничении жидкостей;
- прогрессирующие тяжелые патологии печени (но в таких случаях могут использоваться только специализированные растворы).
Стандартные аминокислотные растворы
В состав таких средств входят незаменимые и некоторые заменимые аминокислоты. Их соотношение диктуется обычными потребностями организма.
Обычно используются 10% растворы, в 500 мл которых содержится 52,5 г белка (или 8,4 г азота). К таким стандартным аминокислотным растворам относятся следующие препараты:
- Аминоплазмаль Е;
- Аминостерил КЕ;
- Вамин.
В некоторых белковых препаратах концентрация составляет от 5,5 до 15 %. Низкопроцентные растворы (Инфезол 40, Аминоплазмаль Е 5% и Аминостерил III) могут вводиться в периферические вены.
Специализированные аминокислотные растворы
В таких препаратах содержится измененный аминокислотный состав.
Существуют такие специализированные растворы аминокислот:
- с повышенным содержанием аминокислот с разветвленной цепью и пониженным содержанием ароматических аминокислот – Аминоплазмаль Гепа, Аминостерил N-Гепа;
- включающие преимущественно незаменимые аминокислоты – Аминостерил КЕ-Нефро.
Донаторы энергии
К группе этих средств для ПП относят:
- жировые эмульсии;
- углеводы – спирты и моносахариды.
Жировые эмульсии
Эти средства являются наиболее выгодными поставщиками энергии. Обычно калорийность 20% жировых эмульсий составляет 2,0, а 10% – 1,1 ккал/мл.
В отличие от углеводных растворов для ПП у жировых эмульсий есть ряд преимуществ:
- меньшая вероятность развития ацидоза;
- высокая калорийность даже при малых объемах;
- отсутствие осмолярного действия и низкая осмолярность;
- уменьшение процессов окисления жиров;
- присутствие жирных кислот.
Введение жировых эмульсий противопоказано в следующих случаях:
- шоковое состояние;
- ДВС-синдром;
- гиперлипидемия;
- гипоксемия;
- ацидоз;
- нарушения микроциркуляции.
Для ПП используются такие три поколения жировых эмульсий:
- I – длинноцепочечные эмульсии (Липофундин S, Липозан, Липовеноз, Интралипид);
- II – среднецепочечные жирные кислоты (или триглицериды);
- III – эмульсии с преобладанием Омега-3 жирных кислот (ЛипоПлюс и Омегавен) и структурированные липиды (Структолипид).
Скорость введения 20% эмульсий не должна превышать 50 мл/час, а 10% – не более 100 мл/час. Обычное соотношение вводимых при ПП жиров и углеводов – 30:70. Однако такая пропорция может изменяться и доводиться до 2,5 г/кг.
Граница максимальной инфузии жировых эмульсий должна строго соблюдаться и составлять 0,1 г/кг/ч (или 2,0 г/кг/сутки).
Углеводы
Именно углеводы наиболее часто применяются в клинической практике ПП. Для этого могут назначаться следующие растворы:
- глюкоза – до 6 г/кг/сутки при скорости введения 0,5 г/кг/ч;
- Инвертаза, фруктоза, Ксилитол, Сорбитол – до 3 г/кг/сутки при скорости введения 0,25 г/кг/ч;
- Этанол – до 1 г/кг/сутки при скорости введения 0,1 г/кг/ч.
При частичном ПП дозировки углеводов уменьшают в 2 раза. При максимальных дозах в обязательном порядке делают перерыв во введении на 2 часа.
Витамины и микроэлементы
Коррекция дефицита таких веществ проводится по мере необходимости при различных патологиях. В качестве витаминных и микроэлементных растворов для ПП могут назначаться следующие препараты:
- Виталипид – вводится вместе с жировыми эмульсиями и содержит жирорастворимые витамины;
- Солювит N – смешивается с раствором глюкозы и содержит взвесь водорастворимых витаминов;
- Церневит – вводится с раствором глюкозы и состоит из смеси водо- и жирорастворимых витаминов;
- Аддамель Н – смешивается с аминокислотными растворами Вамин 14 или 18 без электролитов, Вамин с глюкозой, Вамин 14 или с глюкозой с концентрацией 50/500 мг/мл.
Двух- и трехкомпонентные растворы
В состав таких средств входят подобранные в необходимых пропорциях и дозах аминокислоты, липиды, глюкоза и электролиты. Их использование имеет ряд весомых преимуществ:
- простота и безопасность применения;
- одновременное введение;
- уменьшение вероятности инфекционных осложнений;
- экономическая выгода;
- возможность добавления дополнительных витаминных и микроэлементных средств.
Такие растворы помещаются в пластиковые системы «все в одном» и разделены между собой секциями, которые при использовании препарата без усилий разрушаются обычным скручиванием мешка. При этом все компоненты препарата легко смешиваются между собой и образуют похожую на молоко смесь. В результате все растворы для ПП могут вводиться одновременно.
К двух- и трехкомпонентным растворам для ПП относятся следующие препараты:
- Нутрифлекс спешиал – содержит аминокислоты и раствор глюкозы;
- ОлиКлиномель No 4-550Е – предназначен для введения в периферические вены, содержит в аминокислотном растворе электролиты и кальций в растворе глюкозы;
- ОлиКлиномель No 7-1000Е – предназначен для введения только в центральные вены, содержит такие же вещества, как и ОлиКлиномель No 4-550Е;
- ОлиКлиномель – в трех секциях мешка содержится аминокислотный раствор, жировая эмульсия и раствор глюкозы, может вводиться в периферические вены.
Мониторинг состояния пациента при парентеральном питании
 Лица, получающие парентеральное питание, нуждаются в регулярном контроле ряда показателей анализа крови.
Лица, получающие парентеральное питание, нуждаются в регулярном контроле ряда показателей анализа крови.
Пациентам, находящимся на ПП, регулярно проводится контроль таких показателей анализов крови:
- гемоглобин;
- глюкоза;
- натрий, калий, хлор;
- коагулограмма;
- креатинин;
- триглицериды;
- альбумин;
- мочевина;
- билирубин, АЛТ и АСТ;
- КЩР;
- магний, кальций, цинк, фосфор;
- В12 (фолиевая кислота).
В моче пациента контролируются следующие показатели:
- осмолярность;
- натрий, калий, хлор;
- мочевина;
- глюкоза.
Частота выполнения анализов определяется длительностью ПП и стабильностью состояния больного.
Кроме этого, ежедневно проводится мониторинг показателей артериального давления, пульса и дыхания.
Возможные осложнения
При ПП возможно развитие осложнений следующего характера:
- технические;
- инфекционные (или септические);
- метаболические;
- органопатологические.
Такое разграничение иногда является условным, поскольку причины осложнений могут быть сочетанными. Однако профилактика их возникновения всегда заключается в регулярном мониторинге показателей гомеостаза и строгом соблюдении всех правил асептики, техники постановки и ухода за катетерами.
Технические осложнения
Эти последствия ПП возникают при неправильном создании доступа для введения питательных растворов в сосуды. Например:
- пневмо- и гидроторакс;
- надрывы вены, в которую вводится катетер;
- эмболия и другие.
Для предотвращения подобных осложнений необходимо строгое соблюдение техники установки внутривенного катетера для ПП.
Инфекционные осложнения
Такие негативные последствия ПП в ряде случаев вызываются неправильной эксплуатацией катетера или несоблюдением правил асептики. К ним относят:
- тромбозы катетера;
- катетерные инфекции, приводящие к ангиогенному сепсису.
Профилактика этих осложнений заключается в соблюдении всех правил ухода за внутривенным катетером, применении защитных пленок, силиконированных катетеров и постоянном соблюдении правил строгой асептики.
Метаболические осложнения
Эти последствия ПП вызываются неправильным применением питательных растворов. В результате таких ошибок у пациента развиваются нарушения гомеостаза.
При неправильном введении аминокислотных составов могут возникать следующие патологические состояния:
- дыхательные нарушения;
- азотемия;
- нарушения психики.
При неправильном введении углеводных растворов могут возникать следующие патологические состояния:
- гипер- или гипогликемия;
- гиперосмолярная дегидратация;
- глюкозурия;
- флебит;
- нарушения функций печени;
- дисфункции дыхания.
При неправильном введении жировых эмульсий могут возникать следующие патологические состояния:
- гипертриглицеридемия;
- непереносимость препарата;
- синдром перегрузки липидами.
Органопатологические осложнения
Неправильное проведение ПП может приводить к дисфункциям органов и обычно связано с метаболическими нарушениями.
Чаще такие последствия ПП вызываются нерациональным введением углеводных средств. У больного может развиваться гипергликемия, глюкозурия и гиперосмолярный синдром. Кроме этого, гипергликемия может являться первым признаком развития катетерного сепсиса, а появление сахара в моче указывать на гипокалиемию.
Неправильное применение углеводных составов способно вызывать и следующие органопатологические осложнения:
- гипогликемия (при передозировке инсулина, добавляемого в раствор глюкозы);
- увеличение минутного объема дыхания (у истощенных больных);
- жировая инфильтрация печени (при чрезмерной активации липонеогенеза).
Неправильное введение жировых эмульсий может приводить к ранним или поздним осложнениям.
Ранние последствия проявляются различными острыми реакциями на инфузию препаратов в виде:
- аллергии и реакций гиперчувствиельности;
- потоотделения;
- одышки;
- головокружения;
- цианоза;
- головной боли;
- повышения температуры;
- тошноты и рвоты;
- болей в пояснице;
- воспалений в месте введения инфузии.
Поздние осложнения ПП, связанные с неправильным применением жировых эмульсий, выражаются в развитии:
- холестаза и гепатомегалии;
- тромбоцитопении;
- лейкопении;
- спленомегалии.
Превышение норм введения аминокислотных составов способно приводить к развитию азотемии. Избыток протеинов может вызывать легочные нарушения у больных с хроническими патологиями легких. Кроме этого, применение стандартных растворов аминокислот для пациентов с дисфункциями печени способно провоцировать печеночную энцефалопатию, приводящую к нарушениям психики.
Особенно вероятно развитие осложнений при проведении длительного ПП. Такие последствия могут проявляться в виде:
- гиповитаминозов;
- недостатка микроэлементов;
- нарушения свертываемости крови из-за недостатка витамина К;
- заболеваний желчного пузыря, возникающих из-за снижения его сократительной функции и нарушений состава желчи;
- остеопороза, спровоцированного нарушением метаболизма витамина D.
К какому врачу обратиться
Парентеральное питание может назначаться врачами различных специализаций. Примерно в 60-70 % случаев оно проводится пациентам отделений реанимации или интенсивной терапии.
Доклады специалистов на тему «Парентеральное питание»:
Основные принципы назначения и проведения парентерального питания
Парентеральное питание — объём, электролиты, осмолярность, рН? Е.П.Ананьев
Посмотрите популярные статьи
Комментарии
Опубликовано в журнале:
Научно-практический журнал «Детская больница» 2007 (Ассоциация детских больниц).
Лазарев В.В., Цыпин Л.Е., Корсунский А.А., Байбарина Е.Н.
Кафедра детской анестезиологии и интенсивной терапии ФУВ Российской Детской Клинической больницы, Научный Центр Акушерства, Гинекологии и Перинатологии РАМН
В последние годы особое внимание уделяется вопросам рационального питания пациентов, находящихся на стационарном лечении. Статистические данные свидетельствуют, что 30-40% пациентов педиатрических стационаров имеют нарушения пищевого статуса. Среди детей, госпитализированных по экстренным показаниям, в 70% случаев нарушения питания остаются нераспознанными, что является отягощающим фактором в эффективности лечения, неизменно ведет к ухудшению клинического прогноза и результата. Исследователями установлена взаимосвязь между недостаточностью питания и количеством осложнений, летальностью. При снижении массы тела пациентов на 5% за время нахождения в стационаре продолжительность их госпитализации возрастает в 3,3 раза.
Нарушение пищевого статуса снижает иммунорезистентность, увеличивает риск инфекций, ухудшает процессы регенерации, вызывает гастроинтестинальную дисфункцию, увеличивает затраты на лечение. Поэтому в настоящее время стандарт лечебных мероприятий включает «нутритивную поддержку», задачей которой является обеспечение полноценным питанием больных и пострадавших.
Целью искусственного лечебного питания (нутритивной поддержки) является обеспечение пациента необходимым количеством калорий и сохранение его собственного белка с помощью ряда методов, отличных от обычного приема пищи.
Основополагающими принципами искусственного лечебного питания являются своевременное начало, полноценность и оптимальный срок продолжительности. Лечебное питание осуществляют до достижения стабильных показателей, отражающих процессы метаболизма, антропометрических и иммунологических параметров. Лечебное питание проводят с помощью орального, энтерального, частичного или полного парентерального питания (ПП).
Форму питания устанавливают на основании клинико-лабораторных показателей, возрастных и анатомо-физиологических особенностей каждого конкретного больного. Из множества факторов, влияющих на форму проведения лечебного питания, наиболее значимыми являются: 1) наличие или отсутствие сознания, 2) состояние функции сосания, жевания и глотания, 3) степень проходимости верхних отделов пищеварительного тракта, 4) выраженность недостаточности питания, 5) объем и характер оперативного вмешательства, 6) состояние пищеварения и всасывания при анатомической сохранности желудочно-кишечного тракта, 7) вид кишечной фистулы, 8) степень гиперкатаболизма.
Каждый из способов доставки питания имеет свои достоинства и недостатки. У больных при различных патологических состояниях, когда нет возможности проводить питание естественным путем через желудочно-кишечный тракт это позволяет сделать парентеральное питание. Нефизиологичность парентерального пути введения питательных компонентов компенсируется биологической активностью и доступностью этих веществ, что позволяет оказывать целенаправленное влияние на метаболические процессы и значительно быстрее получать необходимые результаты.
ПП новорожденных и детей до 2 лет.
Вопросы нутритивной поддержки новорожденных, находящихся в отделениях и палатах интенсивной терапии, занимают особое место ввиду значительных физиологических и морфологических различий у детей данной возрастной группы по сравнению со старшими. Так у них уровень основного обмена в 2 раза, а потребность в жидкости в 5 раз выше, чем у взрослых в то время как фракция экскреции натрия в 10 раз меньше. В первые дни жизни происходит существенное перераспределение жидкости между секторами, существенную роль могут играть неощутимые потери. Следует отметить также, что в силу структурной и функциональной незрелости органов пищеварения способность недоношенных новорожденных к самостоятельному энтеральному питанию ограничена. Устойчивая перистальтика у плода появляется только после 28-30 недель гестации, координация сосания и глотания развивается после 33-36 недель гестации, процесс всасывания жирных кислот с длинной цепью затруднен в связи с недостаточной активностью желчных кислот, секреторная функция поджелудочной железы полностью устанавливается только к концу первого года жизни.
Потенциальные последствия недостаточного питания у недоношенных новорожденных
| Малые энергетические резервы | Раннее наступление катаболической стадии |
| Влияние на РДС | Снижение (задержка) синтеза сурфактанта. Слабость дыхательной мускулатуры |
| Защита от гипероксии/баротравмы | Снижение целостности эпителия, Инактивация системы защиты от свободных радикалов |
| Развитие БЛД | Снижение биосинтеза в легких Замедление восстановления поврежденных клеток |
| Влияние на рост легких | Замедление структурного созревания (альвеолизация) |
| Возрастает риск развития инфекции | Повышение проницаемости клеточных барьеров Угнетение клеточного и гуморального иммунитета |
Хотя в мире активно применяются препараты для ПП, доступные в нашей стране, используется этот метод питания у новорожденных недостаточно широко и не всегда адекватно. Внедрение современных протоколов адекватного питания в отделении неонатальной интенсивной терапии способствует улучшенному потреблению и усвоению питательных веществ, росту ребенка, сокращению пребывания его в стационаре и, следовательно, снижению стоимости лечения.
В выполнении ПП у новорожденных особое значение имеет оценка его эффективности. Классические критерии, как прибавка массы тела и увеличение толщины кожной складки в острых ситуациях отражают в основном динамику водного обмена. При отсутствии патологии со стороны почек возможно использование метода оценки инкремента мочевины, который основан на том, что если молекула аминокислоты не вступает в синтез белка, то происходит ее распад с образованием молекулы мочевины. Разница концентрации мочевины после и до введения аминокислот называется инкрементом. Чем он ниже (вплоть до отрицательных величин), тем выше эффективность ПП. Можно пользоваться также приблизительным расчетом баланса азота исходя из того, что 65% его выделяется с мочевиной, поскольку классический метод определения баланса азота крайне трудоемок для рутинного применения. Этот показатель хорошо коррелирует с другими клиническими и биохимическими показателями и позволяет контролировать адекватность проводимой терапии.
При проведении полного ПП новорожденным старше 7 дней доза аминокислот должна составлять 2-2,5г/кг, жира — 2-4 г/кг, глюкозы — до 12-15 г/кг в сутки. При этом энергетическое обеспечение составит до 80-110 ккал/кг. К указанным дозировкам надо приходить постепенно, увеличивая количество вводимых препаратов в соответствии с их переносимостью, соблюдая при этом необходимую пропорцию между пластическими и энергетическими субстратами.
Доля энергии в ПП новорожденных, поставляемой углеводами и жирами, может быть различной. По классическим схемам ПП за счет глюкозы дети получают 60-70% небелкового энергообеспечения, за счет жира 30-40%. При введении жиров в меньших пропорциях задержка белка в организме новорожденных уменьшается, что требует не только обязательного введения жиров в ПП новорожденных, но и соблюдение их соотношения к аминокислотам и углеводам. Примерное суточное введение энергии должно быть следующим: 1 сутки жизни — 10 ккал/кг; 3 сутки жизни — 30 ккал/кг; 5 сутки жизни — 50 ккал/кг; 7 сутки жизни — 70 ккал/кг; 10 сутки жизни -100 ккал/кг; с 2 нед. до 1 года -110-120 ккал/кг, хотя реальная потребность может быть значительно выше.
В Европе и США в нутритивной поддержке новорожденных и грудных детей, нуждающихся в ПП, применяются только специальные растворы кристаллических аминокислот (РКА) направленного действия, в основу которых положен аминокислотный состав женского молока, т. е. специальные препараты для детей, содержащие таурин.
Создание этих растворов для детей продиктовано неполноценностью ферментов, участвующих в белковом метаболизме новорожденного и особенно недоношенного ребенка. Некоторые аминокислоты, которые у взрослого являются заменимыми, у новорожденных переводятся в ранг незаменимых. Аминокислотные препараты для ПП новорожденных обогащаются цистеином, метионином, тирозином, таурином. Таурин способствует развитию сетчатки и всасыванию жирных кислот с длинной цепью без участия желчных кислот, поэтому аминокислотные препараты для детей должны содержать достаточное количество таурина. Последние данные о влиянии различных аминокислот свидетельствуют о том, что в состав РКА для детей не следует вводить глютаминовую кислоту (не путать с глутамином!), поскольку вызываемое ею увеличение содержания натрия и воды в глиальных клетках неблагоприятно при острой церебральной патологии. Избыток фенилаланина оказывает нейротоксическое действие у недоношенных детей, поэтому концентрация ароматических аминокислот в адаптированных препаратах снижается.
Аминокислоты с разветвленной цепью (лейцин, изолейцин, валин) способствует созреванию ЦНС. Достаточное количество аргинина предупреждает развитие гипераммонийемии.
Для парентерального питания новорожденных и детей до 2 лет в настоящее время разрешен к применению и используется единственный аминокислотный препарат Аминовен инфант 6% и 10% (Фрезениус Каби, Германия).
Использование всех других аминокислотных растворов у детей до 2-х лет не разрешено, поскольку они не адаптированы для маленьких детей и не имеют зарегистрированного показания к применению в этом возрасте.
|   | Аминовен Инфант 6% | Аминовен Инфант 10% |
| Незаменимых аминокислот | 52% | 52% |
| Разветвленных аминокислот | 30% | 30% |
| Общее содержание азота, г/л | 9 | 14,9 |
| Осмолярность мосм/л | 531 | 885 |
| Углеводы и электролиты | нет | нет |
| Таурин | есть | есть |
| Форма выпуска | 100 мл | 100/(250) мл |
ПП новорожденных и детей старше 2 лет.
На отечественном фармацевтическом рынке для детей старше 2-х лет присутствует значительное число стандартных препаратов, сбалансированных по содержанию незаменимых и заменимых аминокислот: аминовен 5%, 10%, 15%, аминостерил КЕ 10%, инфезол (Германия), вамин 18, вамин EF (Швеция), полиамин, хаймикс (Россия) и др. Данные препараты зарегистрированы и применяются только у пациентов после 2-х лет или более. Следует отметить, что из них только аминовен является стандартным препаратом аминокислот с таурином.
Помимо новорожденных в группу особого отношения по вопросам парентерального питания необходимо отнести и детей находящихся в критических состояниях. Многочисленные исследования показали, что усиление межклеточной кишечной проницаемости при критических состояниях, приводит к увеличению случаев транслокации бактерий и токсинов из просвета кишечника в системный кровоток и в последующем к инфекционным осложнениям, таким как сепсис и синдром полиорганной недостаточности (ПОН). Клинические и экспериментальные данные свидетельствуют, что применение глутамина до или немедленно после хирургического вмешательства, ожогов, в составе интенсивной терапии оказывает защитный эффект и снижает интенсивность повышения кишечной проницаемости. Наиболее успешным оказалось внутривенное применение фармакологических доз глутамина у больных в критических состояниях со сниженной всасывательной способностью кишечника, поскольку при этом было установлено более эффективное восстановление уровня плазменного глутамина. В настоящее время доказано, что глутамин эффективен в отношении «острой» кишечной недостаточности и повышенной проницаемости, но пока невозможно дать заключение о том, оказывает ли глутамин «терапевтический» эффект на повышенную хроническую кишечную проницаемость. Дозы глутамина, оказывающие «защитный» эффект путем предотвращения или уменьшения интенсивности повышенной кишечной проницаемости при внутривенном применении до или немедленно после начала ситуации повреждения должны составлять около 0,34 г/кг/день, соответствующие 0,50 г/кг/день аланил-глутамина. Более того, этот глутамин не должен рассчитываться как часть пищевого белка, потребляемого больным.
Стремление ввести в комплекс препаратов ПП глутамин и тирозин, высоко значимых для поддержания адекватного питательного статуса больных в критических состояниях, привело к созданию Гламина (глутамин — 20 г/1000 мл, тирозин — 2,28 г/1000 мл (в РФ не зарегистрирован)) и Дипептивена — 20% раствора для инфузий, содержащего дипептид аланил-глутамин (глутамин — 13,5 г/100 мл, аланин — 8,2 г/100 мл.
Дипептивен применяется совместно или изолированно при парентеральном или энтеральном питании у детей с рождения. Препарат можно вводить внутривенно вместе с коммерческими растворами аминокислот для парентерального питания (параллельная инфузия или добавление во флакон с аминокислотами) или вводить в многокамерные пакеты для парентерального питания. При энтеральном питании Дипептивен можно вводить внутривенно вместе с низкоосмолярными растворами или в виде отдельной инфузии в центральную вену. Средняя суточная доза составляет 2,0 мл Дипептивена на 1 кг массы тела, что примерно равно 0,4 г дипептида или 0,3 г глутамина на 1 кг массы тела. Пациенты с тяжелым иммунодефицитом могут нуждаться в более высоких дозах дипептида глутамина (до 2,5 мл/кг и более). Так для больных, которым проводят трансплантацию костного мозга, необходимо глутамина 0,37 — 0,57 г/кг/день (2,7 — 4,2 мл/кг/день Дипептивена).
Особое значение в проведении полного парентерального питания уделяется технологии его выполнения имеющей принципиально важное значение при критических состояниях. По данным оценки правильности проведения ПП в 140 ОРИТ США было отмечено, что 47% больных имели респираторный коэффициент (отношение продукции СО2 к потреблению О2) выше 1,0. Это было обусловлено несоблюдением дозировок и скорости введения глюкозы. Помимо излишнего введения глюкозы гипергликемии способствовало и раздельное введение нутриентов. Внедрение новой технологии ПП «три в одном» и отказ от инфузий глюкозы в концентрации более 20%, позволил снизить до минимума число отмечавшихся ранее осложнений.
В настоящее время готовые к использованию препараты «три в одном» в трехкамерном пакете считаются стандартом как для краткосрочного, так и для длительного ПП у детей старшего возраста и взрослых пациентов.
| Показатель | Кабивен (Центральный) | Оликлиномель (7-1000) |
| Азот/небелковые калории | 1/148 | 1/158 |
| Глюкоза/Липиды (ккал) | 55/45% | 62/38% |
| Доля незаменимых АК | 45% | 40,5% |
| Лейцин/Изолейцин | 1/1,45 | 1/1,2 |
| Незаменимые жирные кислоты | 62% | 20% |
| Соотношение ω-3/ω-6 жирных кислот | 1/7 | 1/9 |
| Концентрация глюкозы | 19% | 40% |
Ввиду невысокого содержания в препарате Кабивен глюкозы как источника энергии, он предпочтителен к применению у больных с дыхательной недостаточностью и сахарным диабетом. Препарат предназначен в первую очередь для пациентов старше 2 лет. У детей до 2 лет Кабивен может применяться только по жизненным показаниям при отсутствии специальных адаптированных аминокислотных растворов, содержащих таурин (Аминовен инфант).
Наиболее часто применяемым 3-компонентным препаратом в Европе является кабивен, представляющий собой пакет, состоящий из 3 камер, содержащих раствор аминокислот (вамин18), жировую эмульсию (интралипид) и 19% раствор глюкозы. Камеры разделены перегородками, которые перед применением разрушаются и содержимое пакетов смешивается. Кроме того, преимущества применения технологии «три в одном» перед изолированным введением раствора аминокислот, жировой эмульсии и глюкозы заключаются в отсутствии необходимости рассчитывать дозу, скорость инфузии отдельно аминокислот, жировой эмульсии и глюкозы, соотношение вводимых аминокислот и энергии, соотношение глюкозы и жиров. Используя 3-камерный пакет, следует только выбрать его нужный размер с учетом массы тела пациента. При этом практически исключается риск ошибок в дозировании и технике проведения ПП. В препарате технологически приготовлен максимально сбалансированный состав, что приводит к снижению риска метаболических осложнений. В пакете существует специальный вход для дополнительного введения витаминов и микроэлементов. Это закрытая система, что позволяет минимизировать риск микробной контаминации. В конечном итоге, использование готового препарата, ускоряет и упрощает работу среднего медицинского персонала.
При различных патологических состояниях меняется количественная и качественная потребность в аминокислотах с возникновением их избирательной недостаточности. В этом случае применение стандартных аминокислотных смесей не позволяет в полной мере обеспечить требуемый спектр аминокислотного баланса у пациентов с различной патологией, либо на разных стадиях патологического процесса у одного больного.
При недостаточности функции печени применяются аминостерил N-гепа 8%, аминоплазмаль Гепа. Специфичность этих препаратов определяется сниженным количеством ароматических (фенилаланин, тирозин) аминокислот, метионина и повышенным — разветвленных незаменимых аминокислот (валин, лейцин, изолейцин), а также аргинина.
Повышенное содержание аминокислот с разветвленной цепью обеспечивает детоксикацию аммиака и повышает синтез белка. Сниженный состав ароматических аминокислот и метионина препятствует образованию ложных нейротрансмиттеров. Необходимость повышения содержания аргинина обусловлена потребностью активации детоксикации аммиака в печени и предупреждения гипераммониемии. Поскольку при печеночной недостаточности в крови повышается концентрация ароматических аминокислот, метионина и снижается содержание разветвленных аминокислот, соответственно целесообразно использовать растворы аминокислот с противоположным соотношением данного спектра аминокислот.
В парентеральном питании при комплексной терапии больных с почечной недостаточностью используются специальные растворы аминокислот: Нефротект, Аминостерил КЕ-нефро, (Германия).
Специально подобранный спектр аминокислот данных растворов позволяет добиваться включения азотистых шлаков организма в метаболические процессы с выработкой новых заменимых аминокислот, синтезом белка и снижением азотемии. В перечне требований предъявляемых к растворам аминокислот используемых при почечной недостаточности важное место отводится содержанию углеводов и электролитов, которое должно быть минимальным или вообще отсутствовать.
Увеличение концентрации разветвленных аминокислот в растворах парентерального питания и применение их в постагрессивном периоде снижает потери белка, стимулирует его синтез и уменьшает распад, позитивно влияет на состояние азотистого баланса.
Расчет дозы и режима введения растворов аминокислот определяется питательным статусом больного, азотистым балансом, степенью выраженности нарушений функции почек. Важный фактор утилизации аминокислот и синтеза белка — скорость введения растворов аминокислот, которая не должна превышать 0,15 г/кг/ч.
Актуальность использования жировых эмульсий на сегодняшний день не вызывает сомнений. Их значимость в группе препаратов 1111 определяется не только как наиболее эффективный источник энергии, поскольку при метаболизме 1 г жира образуется 9,3 килокалории. Помимо энергии жировые эмульсии являются источниками незаменимых жирных кислот (линолевой и линоленовой), которые обеспечивают структурными компонентами все клеточные мембраны и способствуют их восстановлению проницаемости и осмотической резистентности. Ненасыщенные жирные кислоты участвуют в синтезе простагландинов, тромбоксанов и лейкотриенов и тем самым оказывают значимое действие на метаболическую и газообменную функцию легких, транспорт жирорастворимых витаминов, активность иммунной системы. Положительное влияние жировых эмульсий заключается и в их изоосмолярности (280-380 мосм/л), что позволяет корригировать осмотическую активность растворов ПП при совместном применении жировых эмульсий, а также вводить их в периферические вены.
В настоящее время существуют различные варианты жировых эмульсий, отличающиеся по составу, соотношению ингредиентов, а тенденции в разработке и создании новых характеризуются появлением жировых эмульсий многокомпонентного состава с содержанием жиров растительного, животного, синтетического происхождения.
Жировые эмульсии
| Стандартные жировые эмульсии | Жировые эмульсии с пониженным содержанием незаменимых полиненасыщенных жирных кислот. | Жировые эмульсии со специфическим соотношением жирных кислот |
При использовании жировых эмульсий важно учитывать, что состоят они вообщем из двух совокупностей частиц: одна с большим содержанием триглицеридов подобно хиломикронам и другая из фосфолипидобогащенных частиц — липосом. Липосомы важны как эмульгатор в жировой эмульсии особенно в сочетании ее с аминокислотами и глюкозой («все в одном»). Количество их в эмульсии зависит от типа триглицеридов и фосфолипидов, а также от их соотношения, и тем выше чем меньше относительное содержание в ней масел. То есть 10% эмульсия содержит примерно в 3 раза больше липосом, чем 20%, и в 10 раз больше, чем 30%. При этом важно, что липосомальные фосфолипиды могут оказывать отрицательное влияние на обмен липопротеинов и модифицировать структуру клеточных мембран. Липосомы могут преобразовываться в частицы со свойствами патологических протеинов — липопротеины-Х, накопление которых становится основной причиной развития гиперхолестеринемии или возрастания соотношения свободный холестерин/эстерифицированный холестерин в плазме крови.
Дальнейшие разработки в области создания жировых эмульсий привели к появлению препаратов, в которых как среднецепочечные триглицериды (МСТ), так и длинноцепочечные триглицериды (LCT) эстерифицированы к одной молекуле глицерина — структурированные триглицериды (СТГ) — в РФ не зарегистрированы. Липолиз СТГ осуществляется быстрее, чем его предшественников и с образованием одновременно МСТ и LCT. Структурированные триглицериды содержат сбалансированное — эквимолярное соотношение среднецепочечных и длинноцепочечных триглицеридов и относительно меньшее количество октаеновой кислоты, поэтому более безопасны, чем MCT/LCT смеси. Представителем этой группы жировых эмульсий является Структолипид (Германия), в составе которой имеются незаменимые жирные кислоты (α-линоленовая — омега-3 жирная кислота, линолевая — омега-6 жирная кислота). После введения эмульсий СТГ концентрация триглицеридов в плазме достоверно ниже, чем при использовании LCT или MCT/LCT смесей, что объясняется их лучшей элиминацией из плазмы и проникновением в митохондрии в не зависимости от наличия карнитина. Они обладают хорошей переносимостью, азотсберегающим эффектом за счет быстрой утилизации и превращения их в кетоновые тела, имеют в своем составе незаменимые жирные кислоты, являются хорошим источником энергии.
В качестве источника полиненасыщенных ω-3жирных кислот применяется препарат Омегавен — 10% эмульсия на основе рыбьего жира. Омега-3, 6 жирные кислоты являются предшественниками синтеза простагландинов, тромбоксана, простациклина, лейкотриена (LTD 5), снижающего продукцию цитокинов (IL-1, IL-6, ФНО), обладают противовоспалительными и иммуномодулирующими свойствами, не оказывают подавляющего действия на продукцию антител и цитолиз клеток, стабилизируют клеточные мембраны. Омегавен предназначен для лечения и профилактики дефицита омега-3-жирных кислот в интенсивной терапии, кардиологии и онкологии.
Новым вариантом жировых эмульсий, в котором сочетаются преимущества четырех различных видов масел, уже используемых в парентеральном питании в настоящее время является СМОФлипид. Она содержит:
30% соевого масла — источник незаменимых жирных кислот — линолевая кислота (жирная кислота семейства ω-6 и α-линоленовая кислота (жирная кислота семейства ω-3) в пропорции, предупреждающей развитие дефицита незаменимых жирных кислот; 30% среднецепочечных триглицеридов; 25% оливкового масла — обеспечение мононенасыщенными жирными кислотами, особенно олеиновой; 15% рыбьего жира — источник ω-3 жирных кислот семейства с очень длинной цепью (эйкозапентаеновой и докозагексаеновой), которые улучшают стандартную клиническую терапию, особенно при гипервоспалительных состояниях, а также применяются в качестве дополнительного метода лечения при травмах, повреждениях и на ранней стадии сепсиса; o Витамина Е (200 мг/л α-токоферола) — поддержание необходимого содержания в организме витамина Е и адекватная антиоксидантная защита. Включение в состав препарата наряду с другими компонентами оливкового масла гарантирует сбалансированное обеспечение жирными кислотами и снижает общую долю полиненасыщенных жирных кислот в эмульсии. Содержание среднецепочечных триглицеридов 60 г/1000 мл позволяет добиваться обеспечения доступной энергией и эффективного удаления триглицеридов из кровотока. СМОФлипид содержит только 30% МСТ, поэтому более безопасен, чем физические смеси (липовеноз МСТ и липофундин МСТ/ЛСТ). Рыбий жир является источником длинноцепочечных жирных кислот семейства ω-3: эйкозапентаеновая кислота (С20:5ω-3) и докозагексаеновая кислота (С22:6ω-3). Скорость введения жировых эмульсий не должна превышать 0,15 г/кг/ч.
Глюкоза, как компонент ПП является не только источником энергии, но и активным участником пластических процессов, синтеза белка. При дефиците энергетических ресурсов для их обеспечения используется белок, аминокислоты, введенные извне или собственно организма, вследствие чего могут наступать процессы катаболизма. Между обменом углеводов, аминокислот и липидов существует тесная взаимосвязь. Глюкоза широко используется в ПП как источник небелковых калорий в виде 20-50% раствора. Однако применению больших объемов высококонцентрированных (превышающих 30%) растворов глюкозы может приводить к увеличению минутного объема дыхания, респираторного коэффициента, продолжительности ИВЛ, гиперосмолярности, гипергликемии, глюкозурии, жировой инфильтрации печени. В связи с чем рекомендуется применять в ПП не более 20-30% растворы глюкозы. В качестве источника углеводов и энергии используются помимо глюкозы также фруктоза, сорбит и ксилит.
Суточную дозу глюкозы (за исключением новорожденных) не следует превышать 6-7 г/кг, но и для обеспечения достаточной эффективности углевода его дозировка не должна быть менее 2-3 г/кг в сутки. Скорость утилизации глюкозы в нормальном состоянии составляет 3 г/кг/ч, а при патологии может снижаться до 1,8-2 г/кг/ч. Эти значения определяют скорость введения глюкозы — не более 0,5 г/кг/ч. Для повышения утилизации глюкозы использовать инсулин в дозе 1 ЕД на 4-5 г сухого вещества глюкозы показано в тех случаях, когда сахар в крови повышается до 10 ммоль/л.
Во избежание развития дефицита витаминов и микроэлементов должны учитываться их суточные потребности для организма с учетом возраста при проведении ПП, особенно у больных, нуждающихся в продленном ПП. Для обеспечения необходимых количеств и состава витаминов используются следующие препараты: Солувит, Виталипид (детский и взрослый) — комплексы водо- и жирорастворимых витаминов, Церневит — поливитаминный комплекс для парентерального введения, включающий водо- и жирорастворимые витамины (кроме витамина К) , а также обычные растворы витаминов (витамин С, витамины группы В, и др.).
В качестве препарата, содержащего микроэлементы (железо, цинк, магний, медь, хром, селен, молибден, фтор, йод) для проведения полного парентерального питания используется Аддамель — 0,1 мл/кг в сутки для детей весом более 15 кг и взрослых (Германия). Препарат характеризуется сбалансированным соотношением 9 микроэлементов, устраняет дефицит (в том числе селена и цинка) и удовлетворяет высокие потребности при тяжелых заболеваниях. Входит в стандарты Европейской Ассоциации парентерального и энтерального питания (ESPEN). Перед применением препарат необходимо развести. Следует учитывать, что он не имеет в своем составе калия и натрия и соли этих элементов должны вводится больному отдельно, соответственно состоянию электролитного баланса и суточным потребностям. При введении внутривенно препарат добавляют к растворам аминокислот или глюкозы.
Возможности проведения парентерального питания в настоящее время позволяют проводить нутритивную поддержку у детей с самой различной патологией, во всех возрастных категориях, любое необходимое по продолжительности время. Это достигается совокупностью используемых компонентов парентерального питания: специальными препаратами, техническими средствами, программами и алгоритмами выполнения ПП. Однако следует отметить, что, несмотря на значительные успехи, достигнутые в разработке и проведении ПП, данный способ поддержания питательного статуса пациента не является естественным. Поэтому следует придерживаться указания — стремиться по возможности переходить от парентерального питания к энтеральному, используя для этого все возможные на сегодняшний день средства и методы нутритивной поддержки больных детей.
Литература
1. Бахман А.Л. Искусственное питание: Пер. с англ. -М-СПб.: «БИОНОМ» — «Невский диалект», 2001. — 192 с.
2. Основы клинического питания: Материалы лекций для курсов Европейской ассоциации парентерального и энтерального питания: Пер. с англ./ Гл. ред. Л. Соботка. — 2-е изд. — Петрозаводск: ИнтелТек, 2003. — 416 с.
3. Попова Т.С., Шестопалов А.Е., с соавт. Нутритивная поддержка больных в критических состояниях. -М.: ООО «Издат. Дом «М-Вести», 2002. — 320 с.
4. Пруткин М.Е. Протокол парентерального питания в практике отделения интенсивной терапии новорожденных// Вестник интенсивной терапии, 2004г, №3, с.56-61.
5. Руководство по парентеральному и энтеральному питанию /Под ред. И.Е.Хорошилова. — СПб.: Нордмед-Издат, 2000. — 376 с.
6. Штайнигер У., Мюлендаль К.Э. Неотложные состояния у детей. Пер. с нем. -Мн.: Медтраст, 1996. — 512 с.
7. Daurea A. De-Souza, Lewis J. Greene. Intestinal permeability and systemic infections in critically ill patients: effect of glutamine. Critical Care Med 2005 Vol. 33, No. 5, р. 1125-1135.
8. Tresoldi AT, Padoveze MC, Trabasso P et al. Enterobacter cloacae sepsis outbreak in a newborn unit caused by contaminated total parenteral nutrition solution//Am J Infect Control. 2000 Jun;28(3):258-61
9. J. Neu. Glutamine in the Fetus and Critically Ill Low Birth Weight Neonate: Metabolism and Mechanism of Action // Journal of Nutrition. 2001;131:2585-2589
10. Reeds P.J.,Burrin D.G., Davis T.A et al. Protein nutrition of the neonate //Proceedings of the Nutrition Society, Volume 59, Number 1, February 2000, pp. 87-98(12)
Комментарии (видны только специалистам, верифицированным редакцией МЕДИ РУ)
Технические осложнения парентерального питания
Так же, как почти все инвазивные методы лечения, парентеральное питание и, в меньшей степени, энтеральное питание имеют свой круг осложнений, которые могут быть успешно предупреждены, если осуществляется тщательный контроль за проведением парентерального питания.Частота технических осложнений при постановке центральных венозных катетеров у детей существенно снизилась благодаря четкому соблюдению всех правил осуществления этих манипуляций и рентгенологическому контролю положения катетера. Сердечной аритмии, связанной с раздражением катетером, можно избежать, если кончик катетера устанавливать в месте впадения верхней полой вены в правое предсердие, а не в полость сердца. Рентгенологический контроль положения катетера позволяет исключить такое осложнение, как некроз печени в результате инфузии гипертонических растворов непосредственно в печеночные вены.
С заменой поливиниловых катетеров на силиконовые снизилась частота реакций на катетер, как на инородное тело, реже возникают перфорация вены и тромбоз подключичной или верхней полой вены. Подшивание катетера к коже в месте его входа и контроль положения при каждой перевязке, производимой через день, значительно уменьшают возможность случайного смещения катетера. Однако даже при правильном его положении может возникнуть тромбоз вены, особенно у тяжелых больных с сепсисом и замедленной циркуляцией. Тромбоз верхней полой вены в редких случаях может привести к синдрому верхней полой вены, не представляющему серьезной проблемы.
Хотя при патологоанатомическом исследовании детей, у которых стоял катетер в верхней полой вене, иногда обнаруживается тромбоэмболии, клинические ее проявления возникают чрезвычайно редко. Легочная эмболия также описана как редкое осложнение у грудных и маленьких пациентов с длительным стоянием центрального венозного катетера. При парентеральном питании через периферические вены удается избежать большинства технических осложнений, присущих центральным венозным катетерам. Наиболее частые нежелательные последствии катетеризации периферических вен — флебиты и поверхностные инфильтраты, которые можно предупредить путем одновременной инфузии жировых эмульсий. Кроме уменьшения осмолярности и увеличения pH инфузата, добавление жиров обеспечивает непосредственную механическую защиту вены от флебита.
Септические осложнения парентерального питания
Сепсис — одно из наиболее частых и серьезных осложнений парентерального питания у детей через центральные вены. Достоверно установлено, что при длительном нахождении в центральной вене катетер может быть источником бактериемии и септицемии. Микроорганизмы попадают в кровоток непосредственно с катетера, из инфицированных растворов либо из удаленных септических очагов. Однако в последнем случае катетер, являясь инородным телом, фокусирует на себе бактериальный рост. Наиболее важные факторы, способствующие уменьшению частоты септических осложнений, — постановка катетера в строго асептических условиях и тщательный уход за ним со сменой повязок через день. Кроме того, свести до минимума риск инфицирования позволяет использование катетера только для парентерального питания, исключая заборы крови через этот катетер, переливание препаратов крови или введение лекарственных веществ. Создание специальной инфузионной бригады в нашем госпитале и строгое соблюдение всех правил парентерального питания привели к уменьшению частоты сепсиса с 16% до 3,2% в течение первых же 2,5 лет работы бригады.За последние 10 лет существования этого коллектива частота сепсиса при полном парентеральном питании через центральные вены составляет в среднем 4,5%.
Катетеризационный сепсис у больных, получающих парентеральное питание, проявляется лихорадкой, лейкоцитозом, «необъяснимой» глюкозурией или любой комбинацией этих симптомов. Инфекция подтверждается высевом микроорганизмов из крови, взятой из катетера или из любой другой вены. При отсутствии интоксикации катетер должен быть оставлен в вене на первые 24—48 часов после выявления бактериемии, поскольку около 50% лихорадящих больных, у которых стоит катетер в центральной вене, имеют иные причины лихорадки. Если не обнаружены никакие другие очаги сепсиса, катетер следует удалить. Возможен и альтернативный подход — сразу после получения положительных результатов посева крови начать внутривенное введение через этот катетер антибиотиков. Во многих случаях центральный венозный катетер может быть «спасен» с помощью 5—10-дневного курса внутривенного (через этот катетер) введения антибиотиков.
Поскольку именно лихорадящие пациенты чаще всего нуждаются в парентеральном питании, важно очень четко контролировать и документировать у них все, что связано с использованием катетера. Парентеральное питание никогда не является экстренным мероприятием, а потому при наличии показаний к парентеральному питанию у лихорадящего больного он должен быть тщательно обследован для выяснения причин лихорадки перед тем, как приступить к парентеральному питанию в центральные пены. Парентеральное питание ни в коем случае не следует начинать на ранних стадиях тяжелой инфекции, особенно при рецидивирующей септицемии. Если же парентеральное питание проводится на фоне лихорадки, необходимы регулярные посевы крови до тех пор, пока больной не перестанет лихорадить (каждые 1—3 дня).
Парентеральное питание через периферические вены позволяет избежать многих септических и технических осложнений, свойственных центральным венозным катетерам- Мы не наблюдали у детей ни одного случая катетеризационного сепсиса, связанного с парентеральным питанием через периферические вены как с использованием жиров, так и без них.
Метаболические осложнения парентерального питания
Все известные метаболические нарушения могут возникнуть при полном парентеральном питании. Если эти осложнения остаются долгое время нераспознанными, развиваются серьезные последствия. Однако тщательный контроль парентерального питания с соответствующей коррекцией поз вол кет большинству пациентов достаточно легко приспосабливаться к полному парентеральному питанию.
Гипергликемия. В начальных стадиях парентерального питания может отмечаться повышенный уровень глюкозы крови, что лечения не требует, если не приводит к глюкозурии или значительному осмотическому диурезу. При повышении скорости инфузии или концентрации глюкозы в течение 48—72 часов парентерального питания включаются эндогенные механизмы секреции инсулина и уровень глюкозы крови возвращается к норме. Если гипергликемия не проходит за этот период, то к инфузату следует добавить инсулин. Дети, не страдающие диабетом, редко нуждаются во введении инсулина. Пациенты, у которых на фоне стабилизации состояния при парентеральном питании внезапно увеличивается уровень глюкозы крови более 10 ммоль/л или которые по иным причинам требуют дополнительных повышенных доз инсулина, должны быть тщательно обследованы с целью выявления возможных других причин гипергликемии, в частности — сепсиса.
Гипогликемия. Хотя такие симптомы гипогликемии, как обильное потоотделение, спутанное сознание или возбуждение, описаны при внезапном прекращении парентерального питания, мы редко наблюдаем это осложнение у детей. Тем не менее, в любом случае, когда полное парентеральное питание по тем или иным причинам внезапно прерывается, необходимо вводить 10% декстрозу. При прекращении парентерального питания «уходить» от него следует постепенно.
Пациенты, подвергающиеся большим хирургическим вмешательствам, часто становятся менее толерантными к глюкозе в связи с секрецией эндогенных гормонов или инсулиновой резистентностью. Поэтому мы рекомендуем при проведении ПП сокращать вдвое скорость инфузии или вовсе ее прекращать, когда больной берется в операционную. Скорость инфузии может быть восстановлена до предоперационных показателей через 48 часов после операции при условии, что концентрация глюкозы в крови возвратилась к обычному уровню.
Гиперкалиемия. У пациентов, получающих парентеральное питание, может отмечаться повышение уровня калия сыворотки, если в силу анаболической недостаточности вводимый калий не утилизируется полностью. Гиперкалиемия может развиваться также в результате снижения функции почек или сердечного выброса с метаболическим ацидозом при тканевом некрозе или системном сепсисе. В таких ситуациях количество калия в инфузате должно быть уменьшено либо его вовсе следует исключить, пока гиперкалиемия не будет ликвидирована.
Гипокалиемия. Для ассимиляции вводимых при парентеральном питании растворов и синтезе белка в организме требуется повышенное количество внутриклеточного калия. Поэтому калий необходимо вводить внутривенно из расчета 2—3 ммоль/кг/сут для грудных и маленьких пациентов или 40 ммоль/л для более старших детей и подростков. Могут потребоваться и более высокие дозы, показания к применению которых возникают на основе результатов регулярного исследования концентрации калия в сыворотке.
Гипокальциемия, гиперкальциемия, гипофосфатемия, гиперфосфатеми. Эти состояния, описанные у пациентов, получающих полное парентеральное, обычно возникают, когда к растворам для полного парентерального питания добавляются неадекватные количества кальция и фосфора. Подобных редких осложнений можно избежать, тщательно контролируя уровень кальция и фосфора в сыворотке. В связи с продолжающимся ростом дети, но сравнению с подростками и взрослыми, нуждаются в относительно больших количествах кальции и фосфора.
Гипомагниемия. Подобно калию и фосфору, магний требуется при ускоренных процессах анаболизма и синтеза белка. Гипомагнезиемия может проявляться галлюцинациями, головокружениями, кишечной непроходимостью и гиперрефлексией. Добавление соответствующего количества магния к инфузату полностью устраняет это осложнение.
Недостаточность микроэлементов. Недостаточность цинка нередко возникает при длительном парентеральном питании, обычно у детей с диареей. Клинические проявления заключаются в выпадении волос, себорейном дерматите с локализацией вокруг носа и рта и иногда в кишечной непроходимости. Дефицит меди приводит к гипо- или нормохромной анемии, нейтропении, депигментации кожи и волос, гипотонии, задержке психомоторного развития и остеопорозу. Недостаточность хрома встречается чрезвычайно редко и может вызывать диабетоподобный синдром. Дефицит селена — возможное осложнение очень длительного парентерального питания проявляется мышечными болями и кардиомиопатией. Недостаточность этих микроэлементов редко возникает у больных, получающих добавки микроэлементов к инфузату.
Недостаточность жирных кислот , гиперлипидемия. Лабораторные признаки выраженной недостаточности эссенциальных жирных кислот обычно развиваются не раньше, чем через 2-3 недели безжирового парентерального питания, и заключаются в повышении в сыворотке содержания 5, 8,11- триеновой кислоты, низком уровне линолевой и арахидоновой кислот и увеличении выше 0,4 соотношения триеновой-тетраеновой кислот. Клинические симптомы, как правило, появляются не раньше, чем через 2—3 месяца лечения без жировых эмульсий,и включают в себя чешуйчатый эритематоз, папулезную кожную сыпь, преимущественно и области конечностей, грудной клетки и лица. С этой сыпью можно справиться введением как минимум 4% суточных калорических потребностей в виде линолевой кислоты. Благодаря тому, что при парентеральном питании часть суточных калорийных потребностей обычно вводится внутривенно в виде жиров, недостаточность жирных кислот развивается редко.
Большинство больных, получающих жировые эмульсии, имеют нормальный уровень триглицерида и холестерина в сыворотке. В некоторых редких случаях у пациентов, получающих парентеральное питание дольше месяца, содержание триглицерида в сыворотке может колебаться в пределах 3,5—4,0 ммоль/л (в норме 0,6—1,7 ммоль/л), а показатели холестерина—4,0—6,5 ммоль/л (в норме 2,5—4,0 ммоль/л). Эти изменения редко вызывают какие-либо последствия, и показатели позвращаются к норме обычно сразу после прекращения инфузий жиров.
Нарушения функции печени
Хотя имеются сообщении о нарушениях функции печени, возникающих со 2-го до 14-го дня после начала ТПП, таких как повышение в сыворотке уровня глютама-токсалоацетатной трансаминазы (SGOT) и лактатдегидрогеназы (ЛДГ), глютаматпируватной трансаминазы (SGPT) и билирубина, однако гистологическое исследование печеночной ткани не выявляет каких-либо патологических изменений. Указанные отклонения обычно преходящи, и в большинстве случаев показатели возвращаются к норме сразу после прекращения парентерального питания. Возникающие изменения, как правило, не зависит от того, получает пациент внутривенно жировые добавки к инфузату или нет. Гистологически у большинства больных, получающих жиры внутривенно дольше 1 месяца, в печени в клетках Купфера обычно обнаруживаются жировые пигменты. Роль подобного депонирования пигментов пока еще недостаточно ясна.
Холестатическая желтуха, связанная с полным парентеральном питании, более часто встречается у недоношенных детей, чем у старших пациентов, что, по-видимому, связано с незрелостью билиарной экскреторной системы. Хотя холестатическая желтуха обычно исчезает через 2—3 недели после прекращения парентерального питания, однако в некоторых осложненных случаях может развиться печеночная недостаточность, иногда лаже с летальным исходом. Патофизиология подобного тяжелого поражения печени не ясна, однако не исключено, что определенную роль здесь играет полное отсутствие энтерального питания, а соответственно и отсутствие энтеральной стимуляции выделении желчи, приводящее к ее застою.
Аллергические осложнения парентерального питания
Для детей, получающих регулярно интралипид, довольно характерно развитие в периферической крови эозинофилии в пределах 5—10%. В редких случаях этот показатель может достигать 35%. Подобные изменения не имеют особого клинического значения, если не сопровождаются кожной сыпью или другими проявлениями аллергии, и обычно исчезают, как только прекращается введение интралипида.
Гипергидратация и дыхательная недостаточность. Гипергидратация, сопровождающаяся отеком легких, периферическими отеками или сердечной недостаточностью, редко возникает в тех случаях, когда соблюдаются все правила, описанные выше, а парентеральное питание осуществляется по строгим показаниям и с тщательным контролем. Проведенные в нашей клинике исследования с применением нерадиоактивных изотопов окиси дейтерия показали, что общее содержание воды в организме во время парентерального питания не повышается, а даже уменьшается параллельно с ростом массы тела. Эти данные подтверждают гипотезу о том, что весовые прибавки при парентеральном питании связаны в большей степени с увеличением тканевой массы, чем с задержкой воды.
У пациентов с нарушениями функции легких значительная нагрузка декстрозой при парентеральном питании может способствовать развитию дыхательной недостаточности. Подобное осложнение объясняется повышенной продукцией углекислоты, связанной с углеводным обменом, что требует увеличения дыхательной активности. Если такие больные уже находятся на ИВЛ, то переход на самостоятельное дыхание бывает затруднен. Лечение заключается в уменьшении нагрузки декстрозой и в замещении декстрозных калорий жировыми. Данное осложнение подчеркивает необходимость точного расчета соотношения калорий, обеспечиваемых глюкозой, белками и жирами. Подобные расчеты достаточно хорошо разработаны для взрослых и продолжают разрабатываться в настоящее время для грудных и маленьких детей.